肺癌是我国及全球恶性肿瘤的主要死因。除环境暴露(如吸烟)外,单核苷酸多态性(SNP)亦是公认的影响肺癌易感性的重要遗传因素之一。近20年来,尽管全基因组关联研究(GWAS)已经取得重要进展,但是所鉴定的SNP仍然对肺癌遗传度(heritability)的解释力有限。肺癌属于复杂疾病。复杂疾病的发生、发展受到复杂关联模式的驱动,如基因-环境、基因-基因交互作用等。从统计学上,A、B两因素的交互作用表示两者间存在协同或拮抗作用,或表示A因素的效应随着B因素取值的变化而发生改变。交互作用是两种或多种因素之间的复杂关联模式在群体水平(population level)上所表现出的一种现象,为深入理解疾病发生、发展的机制提供了一种不同寻常的思维方式。然而,全基因组基因-基因交互作用研究涉及超过500亿次的检验。超级沉重的计算负担极大地限制了基因-基因交互作用研究的可行性,迫切需要合理、高效的交互作用降维分析策略与方法。
近日,南京医科大学公共卫生学院陈峰教授、本中心中心主任沈洪兵院士、美国哈佛大学公共卫生学院David C. Christiani教授三方课题组深度合作,联合国际肺癌研究联盟(ILCCO/TRICL),采用“信息熵初筛→对数线性模型检验→logistic回归模型确认”的三步降维分析策略,共同完成了全球最大规模(46.5万人)的肺癌基因-基因交互作用研究与跨种族人群验证,并构建了交互作用赋能的遗传评分(interaction empowered polygenetic risk score, iPRS)。与领域内著名的肺癌遗传评分(PRS-128)相比,iPRS显示出更出色的肺癌风险区分能力,能够进一步提升国际知名肺癌风险预测模型(LLPv3)的高危人群筛查能力。该成果以研究长文(Original Article)形式发表在国际肺癌研究协会(IASLC)官方期刊Journal of Thoracic Oncology杂志(IF=15.609、即时IF= 19.891、中科院/JCR 1区)。南京医科大学公共卫生学院张汝阳副教授、沈思鹏博士、魏永越副教授为论文共同第一作者,陈峰教授、沈洪兵院士、David C. Christiani教授为论文共同通讯作者。

该研究采用两种设计筛选基因-基因交互作用信号:两阶段设计、Meta分析(图1)。(1) 在两阶段设计中,研究人员以国际肺癌研究联盟(ILCCO/TRICL)的欧美人群GWAS数据为筛选集,采用Bonferroni法校正多重比较,从590亿种SNP组合中筛选具有统计学意义的交互作用信号。进一步,以英国生物标本库(UKB)的欧美人群GWAS数据为验证集,进行独立人群的信号验证。(2) 由于不同病理组织类型、吸烟状态、性别的人群存在异质性,肺癌的遗传机制也可能存在差异。因此,研究人员综合所有GWAS样本,对亚组人群中效应微弱的交互作用信号进行Meta分析,以鉴定亚组人群特异性肺癌易感位点。
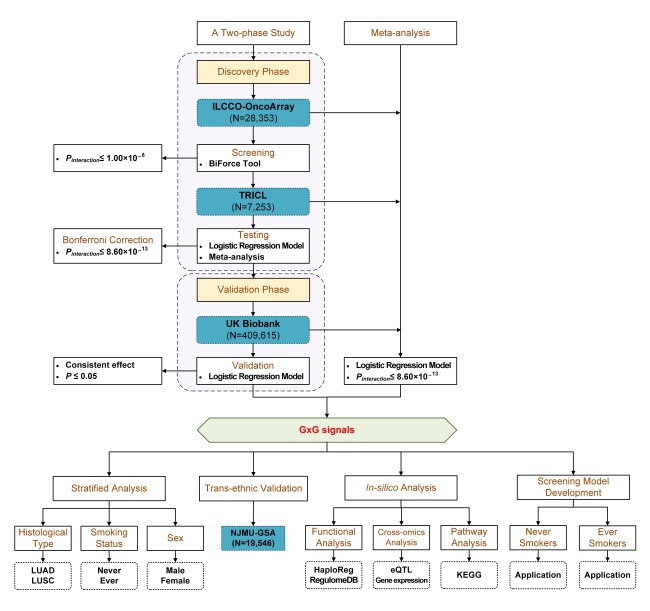
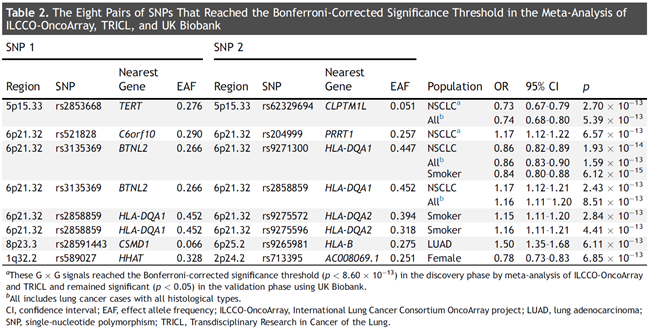
通过两阶段设计,研究人员鉴定出2对存在拮抗作用的信号:位于5p15.33区域TERT基因的rs2853668和CLPTM1L基因的rs62329694、位于6p21.32区域的C6orf10基因的rs521828和PRRT1基因的rs204999。进一步,Meta分析又额外鉴定出6对亚组人群特异性交互作用信号。图2汇总了8对交互作用信号的结果。生物信息学分析显示这些位点或基因可能存在丰富的生物学功能。
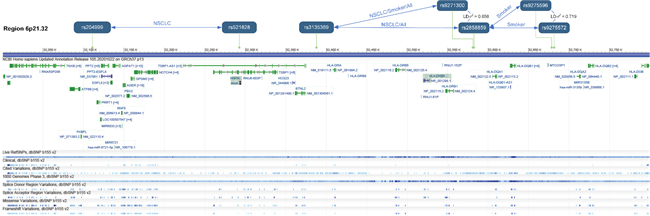
根据位点间的连锁不平衡(LD)分析结果,6p21.32区域的5对交互作用主要由两簇信号所驱动:rs521828-rs204999和rs3135369-rs2858859-rs9275572所驱动(图3)。
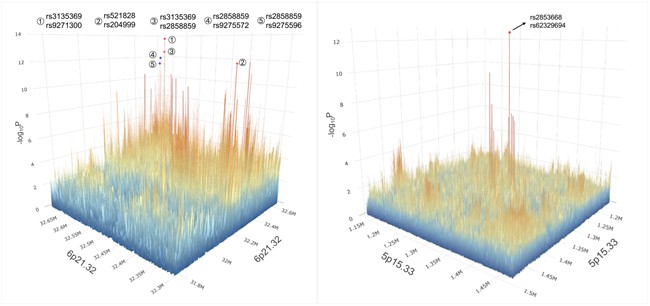
针对ILCCO数据,研究人员进一步对6p21.32和5p15.33区域进行填补分析。如图4所示,两个区域存在成簇基因-基因交互作用信号。
研究人员在本次欧美人群交互作用研究中鉴定出8对信号,在既往亚洲人群(NJMU-GSA)中鉴定出1对信号(2p32.2区域)。跨种族验证分析显示:肺癌基因-基因交互作用在不同种族间既有共同性,又有异质性(图5)。

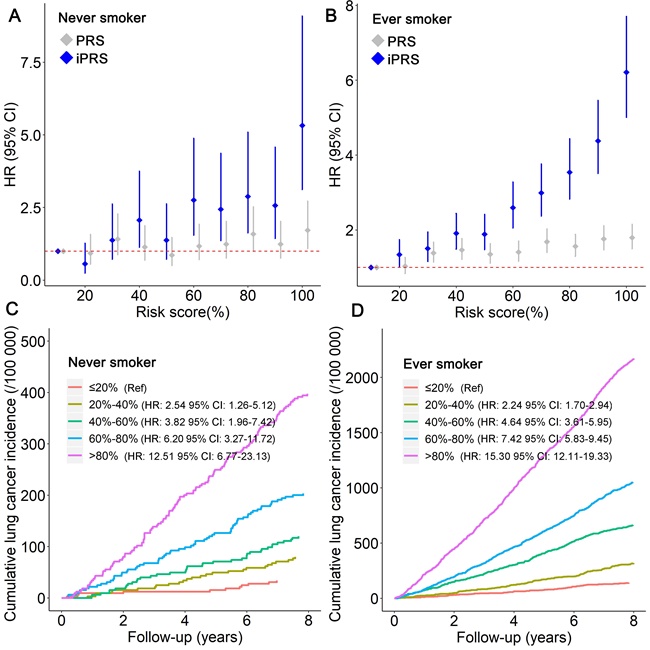
进一步,研究人员分别在不吸烟、曾吸烟人群中构建了iPRS。与领域内知名的PRS-128相比,iPRS具有更出色的肺癌风险区分能力(图6A-B),能够有效甄别肺癌高危人群(图6C-D)。该效果在独立人群中得到验证。
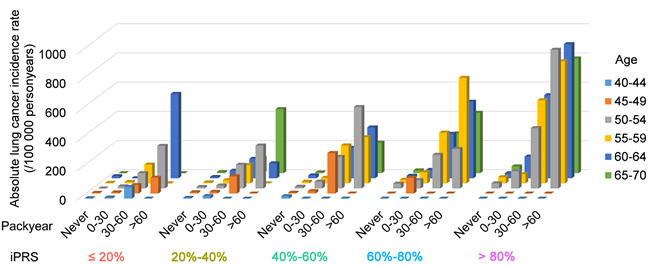
低剂量螺旋CT(LDCT)已经被证实是肺癌筛查的有效措施。目前,美国预防服务工作组(USPSTF)和美国医疗保险与医疗救助服务中心(CMS)仅根据年龄、吸烟史推荐LDCT筛查人群。研究人员发现额外利用iPRS,能够优化LDCT筛查效果。例如,<55岁且吸烟<30年包,但是iPRS较高者可能属于高危人群,应进行LDCT筛查;iPRS>80%分位数且吸烟>30年包者,最好在50岁之前就进行LDCT筛查;iPRS<40%分位数者,允许推迟到60岁后进行LDCT筛查(图7)。
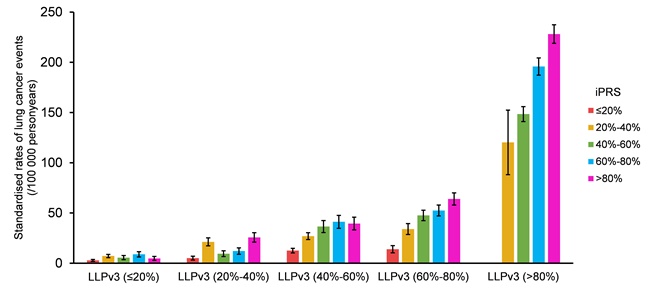
为了提高肺癌筛查的成本效益,近20年来,全球研究者构建了20余种肺癌风险预测模型以识别高危人群。其中,比较著名的模型之一是利物浦肺癌风险模型(LLPv3)。研究人员发现iPRS能够进一步提升LLPv3甄别肺癌高危人群的能力(图8)。
本中心陈峰教授、沈洪兵院士课题组长期聚焦肺癌交互作用研究,曾以共同通讯作者发表了首个亚洲人群肺癌全基因组基因-基因(Chu M, et al. Carcinogenesis. 2014)、基因-吸烟(Zhang R, et al. Carcinogenesis. 2014)交互作用研究成果。Christopher I. Amos教授是美国贝勒医学院临床转化研究所所长、两个顶级全球肺癌研究联盟ILCCO/TRICL的创始人之一,是国际肺癌遗传统计学、流行病学的领军人物。在他的Web of Science高被引论文《肺癌基因组学十年研究进展》中,分别将亚洲人群肺癌基因-基因和基因-吸烟交互作用研究评价为“迄今为止唯一的组学层面基因-基因交互作用研究”和“首个组学层面基因-吸烟交互作用研究”(Bossé Y, et al. Cancer Epidemiology, Biomarkers & Prevention. 2018)。
本次研究不仅是全球规模最大的肺癌基因-基因交互作用研究,也是首个欧美人群全基因组基因-基因交互作用研究和跨种族验证研究,具有重要意义。
特别鸣谢美国贝勒医学院Christopher I. Amos教授、加拿大多伦多大学Rayjean J. Hung教授所领导的国际肺癌研究联盟(ILCCO/TRICL)及所有联盟成员的鼎力支持。